脱落酸的作用高中生物课本上有介绍,这种物质可以抑制细菌繁殖,防止感染。所以,如果家里有孩子,可以给孩子吃一些山楂,可以起到预防感冒的作用。另外,,山楂也有开胃的功效,对于胃口不好的孩子来说,吃一些山楂,可以促进食欲,帮助消化。但是,山楂不能空腹吃,否则会刺激胃酸分泌,引起胃胃痛、腹泻等不适症状。所以,在吃山楂的时候,最好搭配一些酸奶,这样不仅可以补充营养,还能起到养胃的作用。
文章信息
题目:Abscisic acid-responsive transcription factors PavDof2/6/15 mediate fruit softening in sweet cherry
刊名:Plant Physiology
作者:Zefeng Zhai,Yang Liu, Tianhong Li et al.
单位:China Agricultural University
日期:21 September 2022
01
摘要
软化是果实成熟过程中的关键步骤,由多种植物激素之间的相互作用调节。脱落酸(ABA)和生长素的拮抗作用决定了果实成熟和软化的速度。然而,整合 ABA 和生长素信号以调节果实软化的转录因子仍有待确定。在这项研究中,我们基于对两种具有不同果实硬度的甜樱桃 ( Prunus avium L.) 品种的转录组分析,确定了几种 DNA 结合单指 (Dof) 转录因子,这些转录因子对于 ABA 促进的果实软化至关重要。我们表明 PavDof6 直接与编码细胞壁修饰酶的基因启动子结合以激活其转录,而 PavDof2/15 直接抑制其转录。
瞬时过表达甜樱桃果实中的PavDof6和PavDof2/15分别导致早熟和延迟软化。此外,我们发现生长素反应因子 PavARF8,其编码基因的表达被 ABA 抑制,激活PavDof2/15转录。此外,PavDof2/6/15 和 PavARF8 直接结合9-顺式环氧类胡萝卜素双加氧酶 1 ( PavNCED1 ) 启动子并调节其表达,形成 ABA 介导的果实软化的反馈机制。这些发现揭示了果实软化的生理框架,并在 ABA-PavARF8-PavDofs 模块和介导果实软化的细胞壁修饰基因之间建立了直接的功能联系。
02
技术路线
hongdengcaihong、“Burlat”、“Brooks”、“Rainier”、“Summit”、“Lapins”、“Tieton”、“Zaodaguo”共9个甜樱桃品种
果实硬度和植物激素含量的测量
樱桃果实的微观结构评估
甜樱桃的转录组测序
亚细胞定位
Y1H
双荧光素酶报告基因检测
GUS报告基因检测
樱桃果实中的瞬时过表达
03
主要结果
3.1 果实软化过程中细胞壁降解程度决定甜樱桃果肉类型
我们选择了九个具有不同硬度特性的樱桃品种来测量全红 (FR) 果实成熟阶段的果实硬度。品种“Tieton”的果实最硬,其次是“Lapins”和“Brooks”,而果实最软的品种是“早大果”(图1A)。然后我们重点分析了极端品种Tieton和早大果。
因此,我们收集了两个品种在八个果实发育阶段的果实以测量硬度(图 1B)。如图1C所示,在早期阶段,两个品种都表现出高水平的果实硬度。随着果实成熟,硬度逐渐下降,黄白(YW)期达到小绿(SG)期的一半左右,表明YW期是樱桃果实成熟软化的关键时期。值得注意的是,在 YW 阶段后,早大果的硬度下降速度快于Tieton果。
我们还在石蜡切片中检查了这两个品种果实的细胞学特征。我们在早期大绿 (BG) 阶段观察到两个品种相似的细胞结构,其特点是细胞排列小而完整 (图 1D)。随着果实成熟,由于细胞壁和中间薄片退化,细胞体积随着细胞间隙的增加而扩大。值得注意的是,与 Tieton 中 FR 阶段的紧凑细胞结构相比,我们注意到品种早大果的细胞壁存在许多不连续性,表明细胞壁完整性的维持受到损害。我们使用透射电子显微镜 (TEM) 进一步分析了细胞壁分解的超微结构。两个品种的果实都显示出完整的细胞壁结构和密集排列的微丝,细胞膜在 BG 期与细胞壁相邻(图 1E)。在发育后期的 FR 阶段,细胞壁完整性被破坏,如浅色和松散排列的微丝所证明的那样,Tieton 和早大果果实中的中间片层退化和质壁分离。我们注意到早大果的细胞壁破坏比提顿更严重,因为三细胞连接在早大果中完全消失,但仍保留在Tieton中。
为了补充 TEM 分析,我们测量了两个品种 BG、YW 和 FR 阶段细胞壁成分的变化。我们测定了两个品种在果实软化过程中纤维素、半纤维素和共价可溶性果胶(CSP)的含量降低,而水溶性果胶(WSP)和离子可溶性果胶(ISP)的含量在同一时期增加(表1个)。 我们还发现品种之间存在明显差异,因为在 FR 阶段,硬肉 Tieton 果实含有更多的半纤维素和 CSP,而 WSP 和 ISP 则更少。然而,两个品种之间纤维素含量的下降是相当的。总的来说,这些发现表明,甜樱桃的果实软化取决于细胞壁的降解,而品种间果实硬度的差异是由半纤维素和果胶含量的变化而非纤维素引起的。
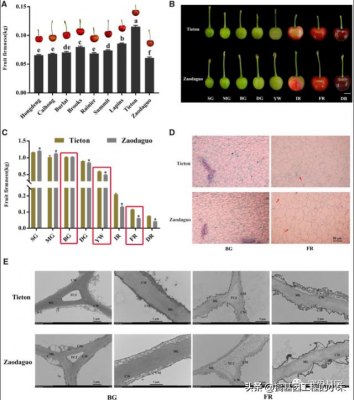
Fig. 1
樱桃果实硬度和微观结构的评价。A, FR 阶段 9 个樱桃品种的果实硬度比较。B, 铁通和枣大果品种果实发育过程中的果实外观。水果已被数字提取以进行比较。比例尺 = 1 厘米。根据Shen 等人,果实发育分为八个时期。(2014). C, 铁通和枣大果品种果实发育过程中硬度的动态变化。红色矩形代表为后续分析选择的发育时期。D, 果肉石蜡切片。红色箭头表示两个品种之间的差异。比例尺 = 50 微米。E, 樱桃果实细胞壁结构变化的超显微检查。CW,细胞壁;厘米,细胞膜;ML,中间层;TCJ,三细胞连接。从所有水果的相同位置分离切片。在 A 和 C 中,数据显示为三个生物复制的平均值±标准差。A 中的不同字母表示 Duncan 的多范围检验具有显着差异,P < 0.05。C 中的星号表示两个品种之间通过学生t检验具有P < 0.05 的统计学显着差异。
3.2 硬肉Tieton和软肉早大果品种果实软化过程中的转录组分析
为了确定甜樱桃果实发育过程中发生的转录变化,使用来自两个品种的 BG、YW 和 FR 果实进行了转录组分析。
层次聚类和主成分分析 (PCA) 强调了同一开发阶段的三个重复的出色重现性 (补充图 S1、A 和 B)。通过品种间比较(T1 与 T2、T2 与 T3、T1 与 T3 和 Z1 与 Z2、Z2 与 Z3、Z1 与 Z3;比较 1)和内部比较获得差异表达基因(DEG;上调和下调) 不同阶段的品种(T1 与 Z1、T2 与 Z2、T3 与 Z3;比较 2)。对比1中,Tieton和早大果分别鉴定出6142个和6418个DEGs(补充图 S2)。
在这两个品种中,下调基因的数量大大高于上调基因的数量。在比较 2 中,确定了 1,607 个(T1 对 Z1)、2,275 个(T2 对 Z2)和 2,560 个(T3 对 Z3)DEG,后期的 DEG 数量越来越多(补充图 S2)。对Tieton和早大果细胞壁相关基因的分析分别鉴定出21个和23个DEGs(比较1),其底物为纤维素、半纤维素和果胶(图2,A和B;补充表 S1 和 S2)。相比之下,从品种内比较(比较 2)中鉴定出的 24 种细胞壁相关 DEG 的底物主要是半纤维素和果胶,进一步证实了半纤维素和果胶代谢对果实软化的关键作用(图2C;补充表 S3)。
接下来,我们使用 PlantTFDB 工具分析了 TF 的 DEG(补充表 S4)。因此,我们在 Tieton 和 Zaodaguo 中分别鉴定了属于 29 个家族的 172 和 169 个 TF 基因(补充图 S3、A、B 和 D)。我们还鉴定了属于 20 个家族的 70 个 TF 基因,并在两个品种之间显示出差异表达(补充图 S3、C 和 E)。我们仔细研究了与植物激素信号相关的 DEG,揭示了与八种植物激素相关的 43 个基因(补充图 S4,A–C)。接下来,共表达分析表明,包括PG、 PL、 PME和XTH在内的 9 个关键结构基因与 28 个 TF 基因和 27 个植物激素相关基因相关,表明植物激素介导的转录网络在甜樱桃中起着关键作用果实软化(图2D;补充表 S5)。我们通过逆转录-定量聚合酶链反应 (RT-qPCR) 验证了 RNA 测序 (RNA-seq) 结果,这说明了两种方法之间的一致性(补充图 S5)。
Fig. 2
甜樱桃中差异表达结构基因的鉴定及重要结构基因、TF基因和植物激素信号基因的相关性分析。A、B、DEGs 的维恩图(左)和结构基因表达水平的热图表示(右),用于比较 Tieton 和早大果样本的不同发育时期(比较 1)。C,DEG 维恩图(左)和结构基因表达水平的热图(右),用于比较三个发育时期的 Tieton 和早大果(比较 2)。对于 (A–C),热图将表达水平显示为 Log 2(TPM + 1)。T, 泰顿样品;Z, 早打果样品;1、BG阶段;2、YW阶段;3、FR阶段。基因名称代表转录组中的基因ID及其基因家族。D, 结构基因、TF基因和植物激素信号基因的共表达分析。每个圆圈的面积是指与显示的每个基因共表达的 DEG 数量。基因首字母缩略词的含义在补充表 S6。BR,油菜素内酯;CK,细胞分裂素;GA,赤霉酸;JA,茉莉酸;SA,水杨酸。
3.3 ABA 促进甜樱桃果实成熟和软化
为了研究 ABA 在调节果实软化中的作用,我们在硬核阶段之前用外源 ABA 或其生物合成抑制剂去甲二氢愈创木酸 (NDGA) 处理樱桃果实。施用 ABA 加速了果实成熟并显着降低了果实硬度,而 NDGA 与用蒸馏水处理的对照果实相比产生了相反的效果(P < 0.05,图 3A 和 B)。与这一观察结果一致,从共表达分析中鉴定出五个关键结构基因的表达(图 2D) 都被外源性 ABA 上调。
此外,ABA 和 NDGA 处理改变了相反方向的内源 ABA 水平,促使我们推测 ABA 生物合成可能在成熟过程中受到影响。为了验证这个想法,我们分析了 RNA-seq 数据中所有NCED家族成员的表达水平,我们发现PavNCED1表达随着果实成熟而增加,表明该基因可能在 ABA 介导的果实软化中发挥作用(补充图 S6、A 和 B)。此外,编码负责 ABA 分解代谢的细胞色素 P450 单加氧酶的PavCYP707A2的表达响应于外源性 ABA 处理而降低,这与之前的报告一致。
这些结果表明,导致甜樱桃果实软化的细胞壁修饰可能受到 ABA 介导的转录调节的调节。C 2 C 2型转录因子 PavDof2/6/15 结合与细胞壁修饰相关的结构基因的启动子并调节其转录输出。
Fig. 3
ABA处理对甜樱桃果实软化的影响。A,用 ABA 或 ABA 生物合成抑制剂 NDGA 处理后第 6 天樱桃果实的表型。比例尺 = 1 厘米。CK,控制检查。B,ABA 或 NDGA 处理后硬度、候选结构基因和与 ABA 代谢相关的关键基因的表达以及 ABA 浓度的变化。数据显示为三个生物复制的平均值±标准差。不同字母表示 Duncan's 多范围检验具有显着差异,P < 0.05。
为了探索在樱桃果实软化过程中参与 ABA 介导的细胞壁修饰的潜在转录因子,我们重点研究了五个结构基因的启动子:gene344 (PavQRT3)、gene3487 ( PavPME44 )、gene5479 ( PavPL18 ) 、 gene9030 ( PavXTH31 )和gene5023 ( PavXTH26 ),软肉品种早大果果实软化的所有关键参与者。我们从早大果确定了它们的启动子序列,并确定了许多 Dof 结合基序 (A/TAAAG;补充图 S7)。然后我们搜索了转录组数据的注释,根据它们在参考基因组中的染色体位置,识别出了 25 个名为PavDof1-PavDof25的PavDof基因(补充图 S8和补充表 S6)。PavDofs 和拟南芥 ( Arabidopsis thaliana ) Dofs 的系统发育分析显示它们聚集成七个亚群 (I–VII)(图 4A)。序列比对表明,所有 PavDof 蛋白都包含一个高度保守的结构域,该结构域由 50-56 个氨基酸残基组成,形成一个 C 2 C 2锌指结构域(图 4B),这是 Dof 家族成员的典型特征。我们确定在早大果的 RNA-seq 数据集中,PavDof2/6/15在果实软化过程中表现出所有 25 个PavDof的最高表达水平(图 4C)。 此外,共表达分析还强调了它们作为关键转录因子参与调节水果软化(图 2D)。有趣的是, PavDof6的表达随着果实发育而增加,并在成熟时达到最高水平,而PavDof2和PavDof15表现出相反的表达模式(图 4D)。我们分析了 PavDof2/6/15 与绿色荧光蛋白 (GFP) 在烟草本氏叶表皮细胞中的融合的亚细胞定位。测试的所有三个 PavDofs 都位于细胞核中(图 4F)。
Fig. 4
PavDof2/6/15 的表征。A,甜樱桃和拟南芥中Dof家族成员之间的系统发育关系。圆圈表示候选 PavDof。B,25 种 PavDof 蛋白中保守的 Dof 结构域的多序列比对。显示了涉及锌指结构和核定位信号基序的四个半胱氨酸残基。突出显示相同的氨基酸。C,早大果中PavDof转录物水平的热图表示。箭头表示候选 PavDof。D, PavDof2/6/15在早大果果实发育和成熟过程中的相对表达水平,通过 RT-qPCR 测定。数据显示为平均值±标准差从三个生物复制品中,每个生物复制品包含 15 个水果。SG,大绿色;MG,中绿色;BG,大绿;DG,学位;YW,黄白色;IR,初始红色;FR,全红;博士,深红色。E,ABA 处理对PavDof2/6/15表达水平的影响。PavActin(Genbank:FJ560908)用作内部对照。数据显示为三个生物复制的平均值±标准差。不同字母表示 Duncan's 多范围检验具有显着差异,P < 0.05。CK,控制检查。F,PavDof2/6/15 的亚细胞定位分析。GFP(阳性对照)或由 CaMV 35S 启动子驱动的PavDof2/6/15-GFP结构分别瞬时渗入本塞姆氏叶。比例尺 = 50 微米。
然后我们使用酵母单杂交 (Y1H) 检测来测试 PavDof2/6/15 是否可以直接调节五个结构基因。如图5A所示,含有猎物构建体 pGADT7-PavDof2/6/15 的酵母(酿酒酵母)共转化体和由来自结构基因的启动子片段组成的诱饵构建体在含有 100 ng·mL -1 的培养基上生长良好aureobasidin (AbA),而阴性对照没有,表明 PavDof2/6/15 直接与酵母中这五个结构基因的启动子结合。我们通过电泳迁移率变动分析 (EMSA) 证实了这些自由度转录因子的结合。当重组纯化的 PavDof2/6/15-HIS 蛋白与含有来自五个感兴趣的启动子的 A/TAAAG 基序的生物素探针单独孵育时,我们观察到流动性的变化。重要的是,当每种重组蛋白与冷探针或携带 Dof 结合基序突变的探针一起孵育时,移动的条带强度降低甚至消失(图 5B )。为了确定每个 PavDof 施加的调节类型,我们进行了双荧光素酶活性测定。PavDof6的过表达强烈激活五个基因的启动子活性,而PavDof2和PavDof15抑制它们的转录活性(图 6)。总的来说,这些结果表明 PavDof2/6/15 通过直接调节甜樱桃中细胞壁修饰基因的转录来调节果实软化。
Fig. 5
PavDof2/6/15 结合与果实软化相关的结构基因的启动子。A,PavDof2/6/15 与PavQRT3、PavPME44、PavPL18、PavXTH31和PavXTH26启动子结合的 Y1H 分析。垂直线表示自由度结合位点 (A/TAAAG),矩形表示用于 Y1H 的启动子片段。AD,pGADT7 空载体;SD,合成成分确定的培养基;AbA、aureobasidin A. B、EMSA 显示 PavDof2/6/15 与PavQRT3、PavPME44、PavPL18、PavXTH31和PavXTH26的结合含有自由度结合位点的启动子片段。未标记的探针用于竞争分析;− 和 + 分别表示不存在或存在。
3.4 瞬时过表达PavDof2/6/15改变甜樱桃的果实硬度
为了确定 PavDof 的功能,我们在各种“Rainier”樱桃果实中瞬时过表达PavDof2/6/15 (图 7A)。因此,我们用含有每个转基因的农杆菌( Agrobacterium tumefaciens )培养物的悬浮液瞬时渗入 100 个果实;在丢弃畸形水果后,我们为每个构建体收集了 45 个水果以供进一步分析。
为了确认在樱桃果实中瞬时表达的成功,我们使用了一对 PCR 引物,设计用于从注射后从水果中提取的基因组 DNA 中扩增载体片段,并检测到大小合适的扩增子(图 7B )。
此外,我们确定PavDof2和PavDof6表达水平分别比对照果实高约 2.5 倍和 3.5 倍,而PavDof15转录本在其相应的转基因果实中积累的水平比对照高约四倍(图 7,C-E)。这些结果表明用PavDof2/6/15过表达构建体成功转化了果实。转基因果实的表型特征表明,OE- PavDof6果实的果实硬度显着降低,而 OE- PavDof2和 OE- PavDof15果实的硬度增加(* P < 0>
Fig. 7
PavDof2/6/15在樱桃果实中的瞬时过表达。A,渗入后 2 周转基因樱桃果实的表型。水果已被数字提取以进行比较。圆圈表示注射部位。比例尺 = 1 厘米。B,转化的确认,基于从对潮霉素抗性基因特异的转基因果实中提取的基因组 DNA 的 392-bp PCR 产物的扩增。C–M,相对PavDof2 (C)、PavDof6 (D) 和PavDof15 (E) 表达水平,硬度 (F),与果实软化相关的结构基因的相对表达水平 (G–J),与果实软化相关的关键基因的表达ABA 生物合成和代谢 (K–L),以及PavDof2 -OE中 ABA 的浓度 (M) ,PavDof6 -OE、PavDof-15 -OE 和对照果实。数据显示为三个生物复制的平均值±标准差,每个生物复制包含 15 个水果。通过学生t检验确定相对于空对照的显着差异(** P < 0.01,* P < 0.05)。
3.5 PavDof2/6/15可以反馈调节PavNCED1的表达影响ABA的生物合成从而间接调控果实软化
由于果实硬度和细胞壁相关基因表达的显着变化,我们推测 ABA 水平可能在 OE- PavDof2、OE- PavDof6和 OE- PavDof15转基因果实中发生类似变化。为了检验这一假设,我们测量了转基因果实中 ABA 代谢基因的表达水平。事实上,与对照相比,OE- PavDof6果实中的相对PavNCED1转录物水平增加,而 OE- PavDof2/15果实中的相对转录水平降低,而PavCYP707A2显示相反的表达模式(图 7,K-L)。与这些结果一致,我们观察到 OE- PavDof6的 ABA 含量转基因果实较高,而与对照相比, OE- PavDof2/15果实较低(图 7M)。
为了测试 PavDofs 是否直接调节 ABA 生物合成,我们通过 EMSA 和 Y1H 测定证实所有三种 PavDofs 都可以与PavNCED1启动子结合(图 8A 和 B)。我们还进行了双荧光素酶活性测定,以评估 PavDof 蛋白对PavNCED1转录的调控方向。PavDof2和PavDof15的过表达强烈抑制了PavNCED1的启动子活性,而 PavDof6 激活了其转录活性(图 8C)。总之,这些观察结果表明 ABA 介导的果实软化也受 PavDof2/6/15 的反馈调节。

Fig. 8
PavDof2/6/15 和PavNCED1启动子之间的相互作用测试。A,EMSA 显示 PavDof2/6/15 与PavNCED1启动子结合,后者包含 Dof 结合位点。未标记的探针用于竞争分析;− 和 + 分别表示不存在或存在。B,PavDof2/6/15 与PavNCED1启动子结合的 Y1H 分析。垂直线表示 Dof 结合位点 (A/TAAAG),矩形表示用于 Y1H 的启动子片段。AD,pGADT7 空载体;SD,合成成分确定的培养基;AbA,aureobasidin A. C, N. benthamiana叶中的双荧光素酶活性测定显示PavDof2/6/15过表达对PavNCED1转录输出的影响发起人。空 SK 载体用作对照。数据显示为三个重复的平均值± SD 。通过学生t检验 (** P < 0.01) 确定相对于空载体控制的显着差异。
3.6 PavARF8 作用于PavDof2/15的上游并参与 ABA 介导的果实软化
为了确定调节PavDof2/6/15表达的潜在转录因子,我们在早大果的PavDof2/15启动子中发现了多个 ARF 结合位点 (AuxRE) ,表明 ARF 转录因子参与了它们的转录调控(补充图 S13)。因此,我们在转录组数据中鉴定了 17 个ARF基因(补充图 S14 和补充表 S7)。其中, PavARF5和PavARF8表达水平在果实发育过程中下降,如我们的 RNA-seq 数据集所示(补充图 S15、A 和 B)。外源性 ABA 处理只会导致PavARF8表达降低,促使我们关注该基因(补充图 S15C)。当PavARF8-GFP构建体瞬时渗入N. benthamiana叶子时,PavARF8 定位于细胞核补充图 S16)。Y1H 测定和 EMSA 证实 PavARF8 特异性结合PavDof2和PavDof15启动子中的 AuxRE(图 9,A 和 B)。这种结合激活了这些启动子,如双荧光素酶测定所证明的,其中PavARF8与包含PavDof2或PavDof15启动子的LUC报告构建体瞬时共渗透(图 9C)。相反,PavARF8 可以直接结合PavNCED1启动子并降低其转录输出(图 9,A-C)。总之,我们的分子研究表明 PavARF8 作用于上游PavDof2/15并参与 ABA 介导的果实软化。

Fig. 9
PavARF8 与果实软化相关基因启动子之间的相互作用。A,PavARF8 与PavDof2、PavDof15和PavNCED1启动子结合的 Y1H 分析。B,EMSA 显示 PavARF8 与包含 AuxRE 的PavDof2、PavDof15和PavNCED1启动子片段的结合。未标记的探针用于竞争测定;− 和 + 分别表示不存在或存在。C,本塞姆氏烟草叶中的双荧光素酶活性测定显示 PavARF8 过表达对所示启动子转录输出的影响。空 SK 载体用作对照。数据显示为平均值±标准差从三个重复。通过学生t检验确定显着差异 (** P < 0.01)。
04
结论
在这项工作中,我们证明了生长素反应因子 PavARF8 与PavNCED1启动子结合(图 9),从而在甜樱桃果实软化过程中 ABA 和生长素信号之间的串扰中建立了潜在的桥梁。
PavARF8 也直接绑定到PavDof2/15启动子并激活它们的转录,突出了 ABA 信号与 PavARF8-PavDof2/15 级联之间在甜樱桃果实成熟和软化中的潜在调节环(图 10 )。
Fig. 10
因此,植物激素和关键软化调节剂显然形成了多个互锁反馈回路,以维持细胞壁修饰基因的适当表达,从而确保向软化进展。总的来说,我们的研究结果不仅为深入剖析甜樱桃果实成熟机制提供了分子基础,而且为更广泛地了解其他非跃变型水果品种的果实成熟提供了有价值的线索。
05
获取原文
原文链接:
https://academic.oup.com/plphys/article/190/4/2501/6709354#
PDF获取:
https://www.scientsgene.com/h-nd-135.html#_np=107_423
文末附件。







